基于无机纳米颗粒、纳米脂质体等纳米粒子的药物递送系统,具有在活体内靶向递送诊疗试剂的潜力,近年来在癌症治疗和疫苗开发中受到了广泛关注。然而,大部分纳米粒子在进入血液循环后会被肝脏巨噬细胞(如Kupffer细胞)捕获,导致药物无法有效到达肿瘤部位。这成为了纳米粒子靶向递送技术的一个主要挑战。这种现象通常是由于纳米粒子表面吸附血清蛋白质(形成“蛋白质冠”)所致,该过程会触发肝脏中的吞噬作用,显著降低了纳米粒子的到达靶点的概率,并增加了肝脏累积毒性。因此,如何规避肝脏捕获并提高肿瘤靶向递送效率一直是纳米医学领域的一个重大挑战。
近期,yl6809永利诸颖研究员、王丽华研究员与上海交通大学樊春海教授合作,开发了一种名为“隐形斗篷”的纳米粒子表面工程技术,成功实现了纳米粒子在体内的高效肿瘤靶向递送。这项研究的核心是利用DNA分子层作为纳米粒子的可降解涂层。这一层DNA不仅能吸附血清中的抗吞噬蛋白(如富含组氨酸的糖蛋白),从而在肝脏中提供功能性的“隐形”效果,还能在肿瘤环境中通过DNA降解来触发肿瘤特异性摄取,相关成果在《Journal of the American Chemical Society》上发表。
。
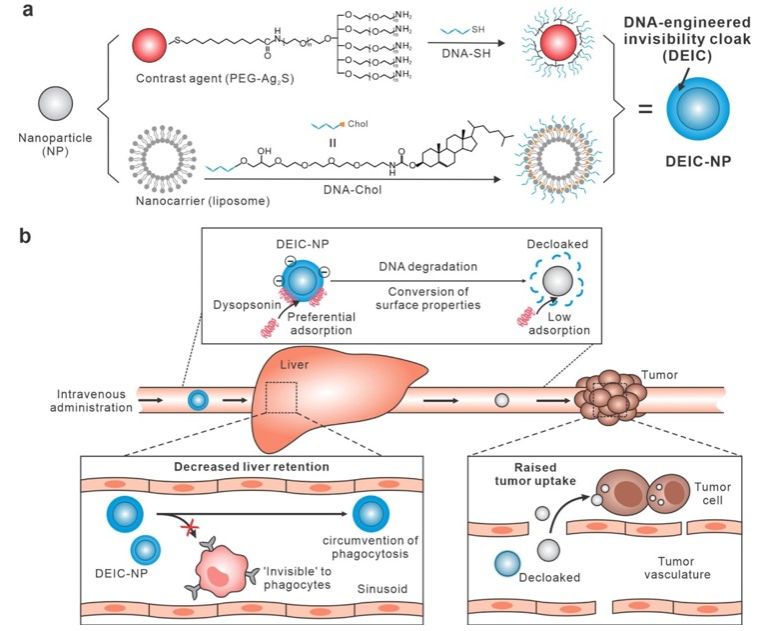
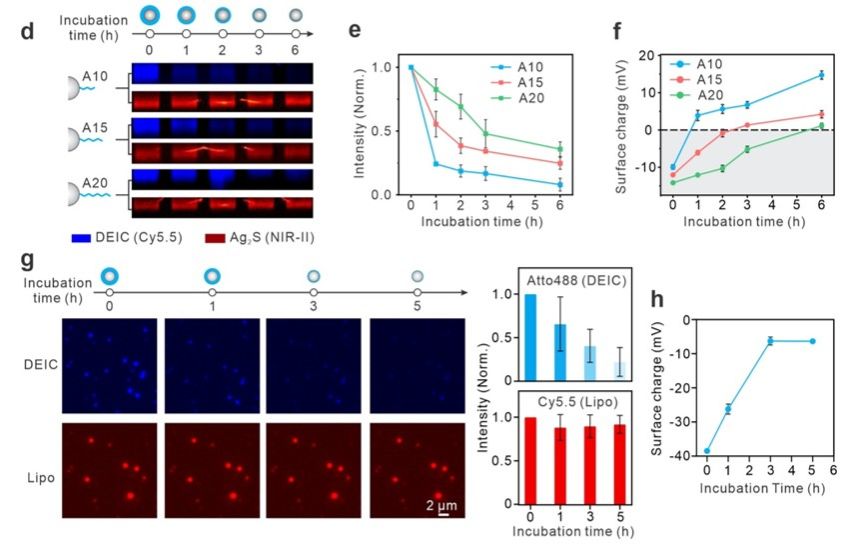
在研究中,团队选择了硫化银量子点和脂质体作为模型纳米粒子,使用DNA分子进行了密集包覆,形成了可降解隐形斗篷纳米粒子。并且,这种隐形斗篷的降解速率可以通过DNA链的长度进行可编程的调控。例如,较短的DNA链(如A10)比较长的链(如A20)降解得更快,因而更快地触发了纳米粒子表面电荷的转变,从而在肿瘤部位实现更高的摄取效率。这种可编程的降解特性使得隐形斗篷纳米粒子系统可以适应不同的生物环境需求,提供了高度灵活的应用前景。
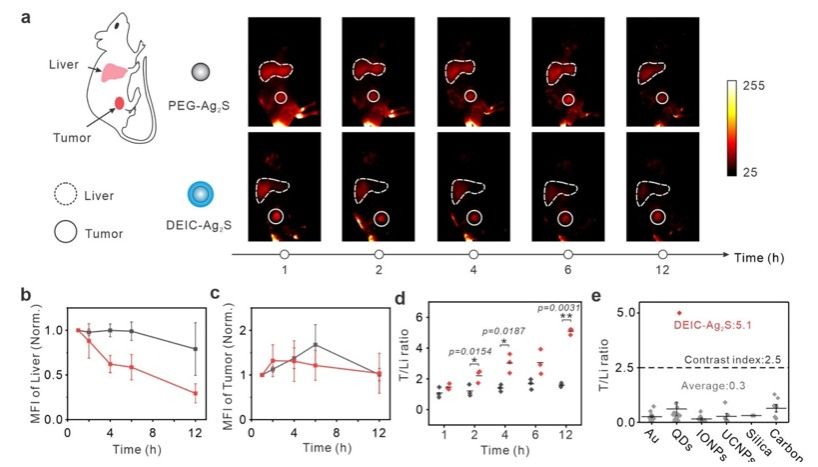
在体内小鼠实验中,通过近红外II区成像,研究人员发现隐形斗篷包裹的硫化银量子点在肿瘤部位的积累量与肝脏相比,达到了约5.1的肿瘤-肝脏信号比,这一结果比传统的纳米材料提高了约18倍。除了硫化银量子点之外,DNA隐形斗篷包裹的脂质体也实现了肿瘤-肝脏信号比的提升,表明这种隐形斗篷可望应用于不同种类的纳米粒子递送系统。总之,这种基于DNA的隐形斗篷系统为肿瘤治疗和精准医疗提供了一种通用而有效的工具,有望在未来的癌症治疗中发挥重要作用。
上述研究得到国家重点研发计划,国家自然科学基金,上海市2022年度"科技创新行动计划"基础研究领域项目和新基石研究员项目的资助。
论文链接:https://pubs.acs.org/doi/10.1021/jacs.4c09479