永利材料生物学研究所孙乐乐副教授与苏州大学功能纳米与软物质研究院刘庄教授近期关注于DNA纳米结构的特殊性质,探讨了利用DNA纳米结构作为自佐剂载体的原理,综述了基于DNA纳米结构的高效亚单位疫苗构建的最新进展,并提出了该领域未来的发展方向。该综述于近日发表在《德国应用化学》(Angewandte Chemie International Edition)杂志。
与利用完整病原体作为抗原的灭活疫苗或减毒疫苗相比,利用免疫活性片段(如来自病原体的蛋白质或表位肽)以及肿瘤新抗原制备的亚单位疫苗能引发更有针对性的免疫反应;且与核酸疫苗不同,它们不需要将活病毒或RNA分子引入体内,从而减少了疫苗相关的副作用。然而,由于蛋白质或肽抗原固有的低免疫原性和较弱的生理稳定性,在疫苗配方中往往需要加入免疫佐剂。佐剂在增强抗原免疫原性方面起着关键作用,主要表现如下:改变抗原的物理性质,以增强生理环境稳定性,从而更有效地激活免疫系统;刺激抗原呈递细胞促进抗原的加工和提呈;刺激淋巴细胞增殖和分化,从而放大免疫效应。
目前,用于人亚单位疫苗的佐剂包括铝盐、toll样受体激动剂等,但表现出的抗原递送能力有限,并伴随一定的毒副作用。除了上述佐剂外,近年来人们还尝试使用各种颗粒载体(包括无机纳米颗粒、脂质体等)、树状大分子和蛋白质载体来递送蛋白质或肽抗原。结构DNA纳米技术的进步使DNA分子成为了构建各种纳米结构的通用组件,通过自组装可以精确控制结构的形态和大小。DNA分子可寻址的特殊性质已被广泛应用于纳米尺度下生物分子的精确空间排列。由于免疫相关受体的激活过程多涉及自身的特定空间排布,因此利用DNA纳米结构增强抗原受体的激活,调控抗原的空间排列具有很大潜力。此外,由于DNA固有的生物相容性和生物降解性,更促进了其在生物医学领域的发展。
有鉴于最近DNA纳米结构在增强亚单位抗原的免疫效应方面的研究进展,本文首先简要介绍了DNA纳米结构所表现出的独特特性;随后,根据最新的研究成果,从保护和递送抗原、精准调控亚单位抗原的排布从而提升免疫反应、精准组装CpG寡核苷酸从而提升抗原呈递这三方面综述了DNA纳米结构作为亚单位疫苗的优秀自佐剂载体的应用;最后,概述了自佐剂DNA纳米结构在开发临床使用的高效亚单位疫苗时可能遇到的挑战,并提出了该领域未来发展的潜在方向(图1)。
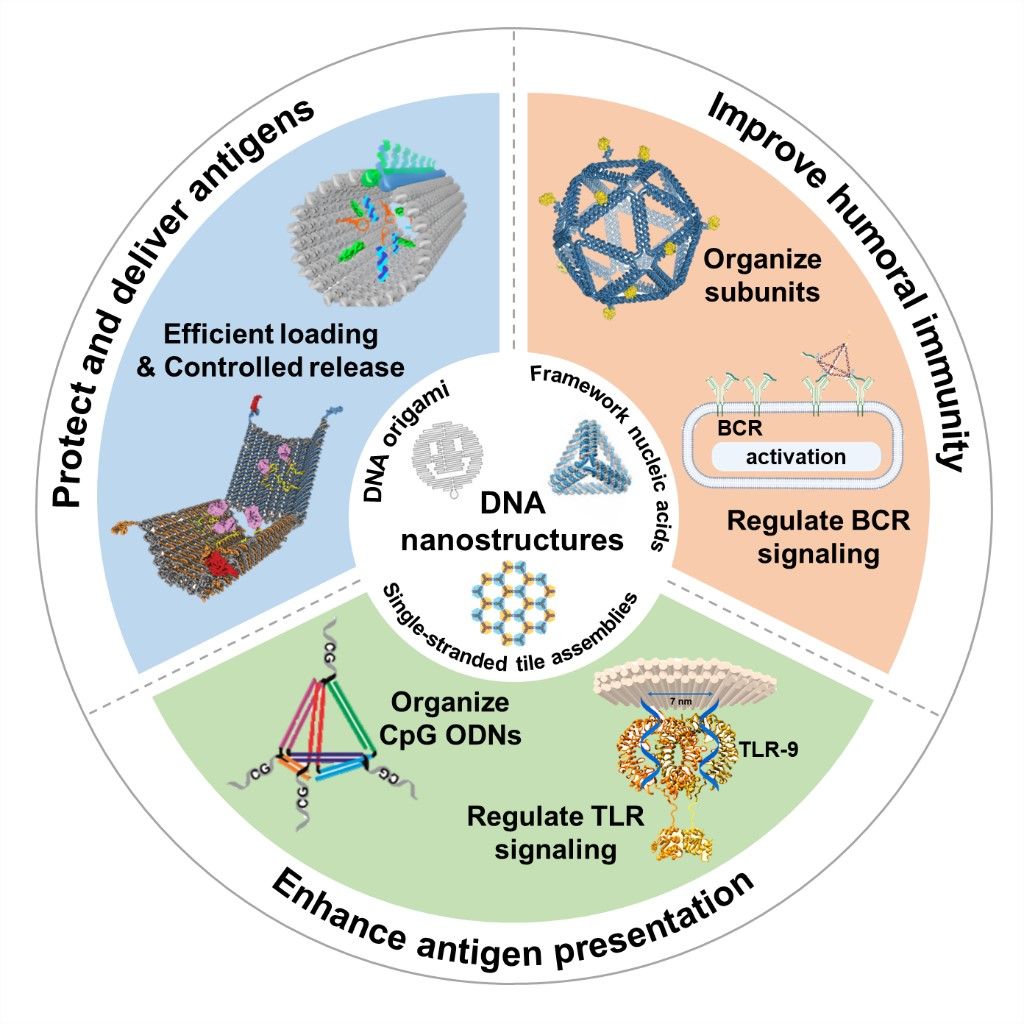
图1. DNA纳米结构能够作为自佐剂载体用于高效亚单位疫苗的构建
孙乐乐副教授所在的永利材料生物学研究所围绕创新核酸生物材料设计及重要领域应用,开展材料生物基元设计与功能化研究,为生物半导体及芯片制造、疾病诊疗等重要领域提供新材料。该综述由永利、苏州大学和上海交通大学组成的联合团队共同完成,并得到了国家自然科学基金委、科技部等项目的资助。
论文链接:https://doi.org/10.1002/anie.202312624